ما هو التوزيع الالكتروني للحديد
العديد من الطلاب يبحثون على التوزيع الإلكتروني الخاص بالحديد، كما يوجد توزيعه خاصة بعنصر الحديد، كما يبحثون أيضا على على الوزن الذري للحديد، ومن خلال مقالنا سوف نعرض التوزيع الالكتروني للحديد وايضا الوزن الذري الخاص بالحديد.
ما هو التوزيع الالكتروني للحديد
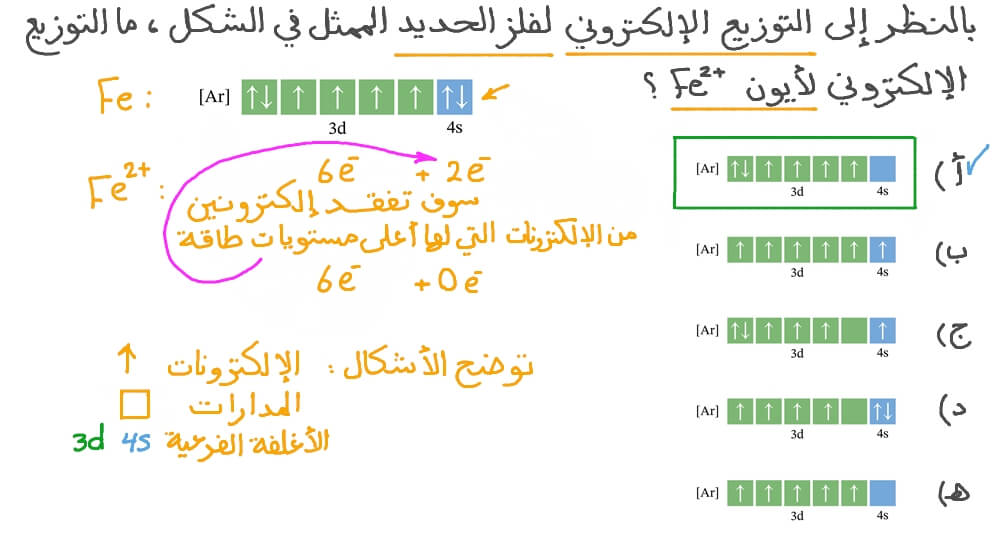
في حالة الحديد، التوزيع الإلكتروني هو 2, 8, 14, 22. السبب في ذلك هو أن المدار 3d يمتلك طاقة أقل من المدار 4s، وبالتالي يتم ملؤه بالإلكترونات قبل المدار 4s1. بعد ملء المدار 3d بـ10 إلكترونات، يصبح له نفس الطاقة كالمدار 4s1. ولكن في حالة الحديد، المدار 3d يحتوي على 6 إلكترونات فقط، وبالتالي يتم ملؤه قبل المدار.
الوزن الذري للحديد
مصطلح الوزن الذري يشير إلى متوسط كتلة ذرات عنصر كيميائي وذلك يكون مقارنة بالمقاييس المعيارية، ولذلك تسمى الكتلة الذرية النسبية بذلك، كما أنه منذ عام 1961م تم اعتماد قياس الوزن الذري وذلك يكون مقارنة بكتلة ذرة من الذرات النظيرة الى عنصر الكربون، كما يعد النظير نوع من انواع ذرات العنصر الكيميائي نفسه كما يوجد له إعداد كتلة ذرية مختلفة في كل من النيوترونات والبروتونات، كما أن الحديد يمتلك أربع نظائر وسوف نعرض نظائرة المختلفة فيما يلي:
| العنصر او النظير | الوزن الذري |
| الحديد | 55.85 غ/مول |
| النظير الأول للحديد | 53.939 غ/مول |
| النظير الثاني للحديد | 53.934 غ/مول |
| النظير الثالث الحديد | 53.935 غ/مول |
| النظير الرابع للحديد | 53.933 غ/مول |
الخصائص الكيميائية لعنصر الحديد
عنصر الحديد يمتلك الكثير من الخصائص الكيميائية التي سوف نعرض عنها فيما يلي:
- المجموعة الدورية: الحديد يتبع المجموعة الدورية الثامنة وذلك يكون في الجدول الدوري الكيميائي.
- الدورة: الحديد يتبع الدورة الرابعة في جدول الدوري الكيميائي.
- مجموعة العنصر: الحديد يكون تابع إلى مجموعة العناصر (d) في جدول دوري الكيميائي.
- العدد الذري: العدد الذري للحديد وفقا الى جدول الذري الكيميائي يبلغ 26.
- التوزيع الالكتروني: يتكون التوزيع الالكتروني الكيميائي الصحيح لعنصر الحديد من 3d6 4s2.
- درجة انصهار الحديد: تتراوح درجة انصهار الحديد من 1,535 إلى 1,538 درجة مئوية.
- الكثافة/ كثافة عنصر الحديد تبلغ 7.8 غم/ سم^3 وذلك عند درجة حرارة 20 درجة مئوية.
- البنية الكيميائية: يشكل بنية تكون بلورية مكعبة عند درجة حرارة الغرفة.
استخدامات عنصر الحديد
يوجد لعنصر الحديد العديد من الاستخدامات التي سوف نعرض عنها فيما يلي:
- تصنيع المعدات الصلبة: يستخدم في تصنيع سبائك الفولاذ الكربوني وذلك يكون بالإضافة إلى العديد من المركبات المختلفة، مثل الكروم والنيكل والمنغنيز وايضا الفاناديوم والتنجستن، ويستخدم الحديد أيضا في تصنيع المواد التي تكون مرتبطة بالهندسة المدنية مثل الخرسانة وايضا العوارض.
- الصناعات الثقيلة: كما يتم استخدام الحديد في تصنيع السلاسل سلاسل الدراجات وايضا تصنيع أدوات القطع والبراميل وأبراج الكهرباء.
- صناعة الانابيب: الحديد يحتوي على 3-5٪ من الكربون ولذلك يتم استخدامه في صناعة الصمامات والأنابيب وايضا المضخات.
- المغناطيس: من الممكن ان تقوم بصناعة العديد من المواد باستخدام الحديد وسبائكه، ومن أبرز ذلك المغناطيس.
- الاستدامة البيئية: يتم إعادة تدوير عنصر الحديد في الطبيعة لكي تعمل على خفض مستويات انبعاث الكربون في الجو، وذلك لكي نقلل من التلوث ويتم رفع مستويات الاستدامة في البيئة.
في نهاية المقال لقد عرضنا ما هو التوزيع الالكتروني للحديد، كما عرضنا أيضا عن الوزن الذري للحديد، وايضا عن الخصائص الكيميائية لعنصر الحديد، وعن استخدامات عنصر الحديد.
Questions & Answers
مجموع القيم العلوية 26، وهو عدد الإلكترونات الصحيح لذرة الحديد.
الحديد عنصرٌ كيميائي رمزه Fe وعددها الذرّي 26، ينتمي إلى عناصر المستوى الفرعي d ويقع على رأس عناصر المجموعة الثامنة في الجدول الدوري، ويصنّف كيميائيًا ضمن الفلزّات الانتقالية.
عند تكوين الأيونات، يفقد الحديد إلكترونين من الغلاف الفرعي 4s، لكنه قد يفقد أيضًا إلكترونًا ثالثًا من زوج الإلكترونات الموجود في مدار الغلاف الفرعي 3d، وهو ما تَنتج عنه حالة تأكسد + 3 .


تعليقات