التوزيع الالكتروني للكربون.. طريقة حساب إلكترونات التكافؤ
التوزيع الالكتروني للكربون من أكثر العناصر التي تحظى باهتمام كبير لكثرة تكرارها في الاختبارات المختلفة، حيث إن ذرات العناصر المتنوعة تأتي مُرتبة في عدد من المدارات، ويُطلق على عدد إلكترونات المدار الأخير بذرات التكافؤ، وتكون هي السبب وراء حدوث التفاعلات الكيميائية المختلفة؛ لهذا من خلال موقعنا سوف نوضح طريقة حساب إلكترونات التكافؤ.
التوزيع الالكتروني للكربون
تُعد إلكترونات التكافؤ في الكيمياء هي الإلكترونات التي تقع ضمن المدار الخارجي من العنصر، ولكل عنصر توزيع خاص به، وتوزيع الكربون يأتي على النحو الآتي:
- يضم الغلاف K أو بما يُعرف بالغلاف الداخلي في الأوربيتال 1S إلكترونين.
- الغلاف L أو الغلاف الخارجي الأوربيتال 2s، و2p يحتوي على أربعة إلكترونات.
طريقة حساب إلكترونات التكافؤ
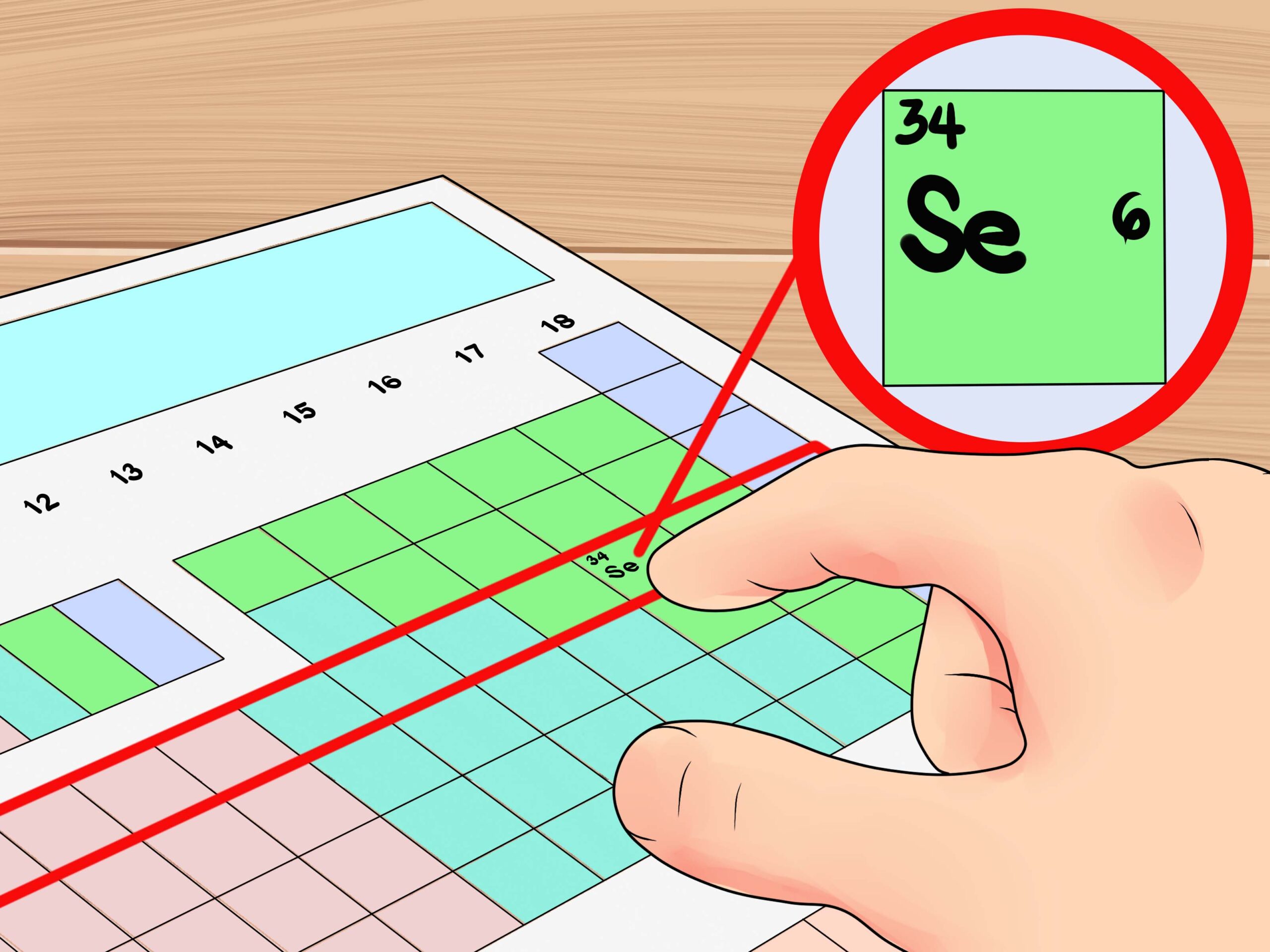
تجدر الإشارة إلى أنه يمكن إجراء حساب إلكترونات التكافؤ بواسطة استعمال الجدول الدوري للعناصر، حيث إن الجدول يُشير إلى كمية كبيرة جدًا من المعلومات المهمة الخاصة بالعناصر الكيميائية، ويستعمله العلماء في تحديد عدد إلكترونات التكافؤ من خلال التحقق من مكان العناصر في الجدول.
حيث إن كافة العناصر الموجودة في عمود رأسي واحد لها ذات عدد إلكترونات التكافؤ، بالإضافة إلى أن رقم المجموعة الرئيسية للذرة يساوي عدد إلكترونات التكافؤ لتلك الذرات، ولكن يتم تجاهل الفلزات، وهي تكون واقعة في كتلة مستطيلة الهيئة، وتتألف من المجموعات من 3 إلى 12.
سبب اختلاف قيم التكافؤ للعنصر نفسه
هناك اختلاف يحدث وهو ظهور نفس العنصر بقيم تكافؤ متنوعة، وذلك يُطلق عليه “خاصية التكافؤ المتغير”، ويكون بسبب التعرض لظروف مختلفة عند حدوث التفاعلات الكيميائية.
عندما يتفاعل عنصر محدد مع عنصر أو مركب آخر تفقد الذرات إلكترونات الغلاف الخارجي، ولكن في أغلب الأحيان قد يحتاج التفاعل فقد المزيد من الإلكترونات، مما يؤدي إلى الأخذ من مدارات الذرة التي تسبق المدار الأخير، وهذا قائم على طبيعة التفاعل، فيكون للعنصر أكثر من تكافؤ واحد.
أهمية معرفة تكافؤ العناصر الكيميائية
يتمتع المصطلح العلمي التكافؤ بأهمية كبيرة في علم الكيمياء، وهذا يعود لما يترتب عليه من استخدامات متنوعة كيميائية، ومن أهميته ما يلي:
- يساعد على تحديد سلوك الذرات إذا كانت تميل إلى فقد أو اكتساب الإلكترونات، وتحديد طريقة تفاعلاها مع باقي الذرات.
- يقوم التكافؤ بتحديد عدد الذرات الداخلية أثناء التفاعل من أجل تكوين الروابط الكيميائية.
- يساهم في تحديد الصيغة الكيميائية للمركبات المتنوعة.
الفرق بين تكافؤ العناصر الكيميائية وعدد التأكسد
يمكن القول إن مفهوم عدد التأكسد يرتبط مع تكافؤ العنصر بصورة رئيسية بإلكترونات التكافؤ للذرة، بالرغم من هذا يكمن الفرق الأساسي بينهما هو أن مصطلح التكافؤ يُشير إلى الحد الأقصى لعدد الإلكترونات التي يتم فقدها من الذرة أو كسبها أو مشاركتها لكي تصل إلى حالة الاستقرار.
بينما عدد التأكسد فهو يدل على عدد الإلكترونات التي تفقدها الذرة أو تكسبها من أجل تكوين رابطة مع ذرة أخرى، وهنا تعبير عن إمكانية استعمال مصطلح التكافؤ لأي عنصر كيميائي، وعدد التأكسد يختص بالمعقدات التناسقية Coordination complexes.
يعتبر التكافؤ بمثابة عدد الإلكترونات التي لا بد أن تقوم الذرة بفقدها أو اكتسابها من أجل الوصول إلى أقرب تكوين إلكترون غاز خامل أي الوصول إلى حالة الاستقرار، ويتم إجراء التوزيع الإلكتروني لكل عنصر لمعرفة إذا كان سيفقد أو يكتسب.
Questions & Answers
لا، لأن الكربون يعتبر ضمن اللا فلزات.
يمكن معرفة الفلزات كونها موجودة على الجانب الأيسر من الجدول الدوري، واللا فلزات تقع في الجانب الأيمن من الجدول.
يعتبر الكربون لا فلز بسبب تركيبه الإلكتروني والخصائص الكيميائية التي يتمتع بها.

تعليقات