التوزيع الالكتروني للصوديوم.. التوزيع الإلكتروني Cr

التوزيع الإلكتروني هو ترتيب الإلكترونات في ذرة أو جزيء، وهو مكان تواجد المدارات الجزيئية أو الذرية، ويتم تحديده لاي نظام بعدد الإلكترونات الموجود فيه ومستويات الطاقة الرئيسية والفرعية، ونوضح في مقالنا التوزيع الالكتروني للصوديوم، ومن خلال موقعنا سوف نتعرف على توزيع الإلكترونات للصوديوم.
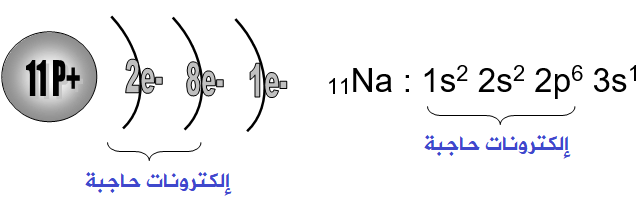
التوزيع الالكتروني للصوديوم
في الجدول التالي نوضح لكم التوزيع الإلكتروني لعنصر الصوديوم:
| 4p | 4s | 3d | 3s | 2s | 1s | |
| 3s1 | 3s1 | 2s2 | 1 s2 | |||
| 1 | 8 | 2 | ||||
كيف يتم حساب التوزيع الإلكتروني
توزيع الإلكترونات على الجدول الدوري يتم تبعًا لقواعد تكافؤ الإلكترونات، وفيما يلي الخطوات العامة لتطبيق التوزيع:
- يتم تحديد عدد الإلكترونات للعنصر، والتي يمكن معرفتها من الجدول الدوري حيث توجد بجانب الأعداد الذرية.
- يتم حساب الطبقات الإلكترونية في التوزيع الالكتروني من خلال استخدام العدد الذري، وهذه الطبقات تشير إلى مدارات الإلكترونات المحتملة حول النواة، حيث إن الطبقة الأولى تتسع ل ٢ إلكترون والثانية ٨ والثالثة ١٨ إلكترون وهكذا.
- يتم توزيع الإلكترونات في الطبقات من خلال وضع ٢ الكتون في الطبقة الأولى مع تواصل وضعها في الطبقات اللاحقة، وذلك تبعًا لثلاث قواعد هي: قواعد البناء الإلكتروني، وقاعدة مندلييف، وقاعدة بولي.
- بعد توزيع الإلكترونات السابقة في الطبقات، يكون هناك بعض الإلكترونات التي لم يتم توزيعها، والتي توجد في الطبقات الخارجية، هي تسمى الإلكترونات الخارجية ((Valence Electrons.
- يمكن توزيع الإلكترونات في الجدول الدوري وفقًا لقواعد تكافؤ الإلكترونات.
- يجب ملاحظة أن تطبيق هذه القواعد قد يكون معقدًا لبعض العناصر، خاصة بالعناصر الثقيلة.
خصائص العناصر الانتقالية
العناصر الانتقالية لها عزم شد وكثافة ودرجة حرارة وغليان ودرجة ذوبان عالية، وهذه الصفات في كثير من العناصر الانتقالية، ويوجد عده خواص عامة للفلزات الانتقالية:
- يمكن أن يكون لهذه العناصر أكثر من حالة تأكسد.
- العناصر الانتقالية تتكون من مركبات ملونة.
- كل هذه العناصر صلبة في درجة حرارة الغرفة ما عدا الزئبق.
- عوامل حفازة جيدة.
- لون العناصر الانتقالية أزرق في درجة حرارة الغرفة ما عدا النحاس والذهب.
- يمكن أن تكون مركبات معقدة تم وصفها في نظرية الحقل البلوري.
لماذا سميت العناصر الانتقالية بهذا الاسم
في النقاط التالية نوضح أسباب تسمية العناصر الانتقالية بهذا الاسم:
- العناصر الانتقالية تم تسميتها بهذا الاسم بسبب موقعها في الجزء الأوسط من الجدول الدوري، فهي تظهر سلوك انتقالي بين عناصر المجموعةS والمجموعةP2 .
- تعتبر العناصر الانتقالية جسر للعبور بين خصائص المعادن الثقيلة الفلزية والأتربة القلوية وذلك بين اللافلزات غير المعدنية والهالوجينات وبين الغازات النبيلة.
استخدامات العناصر الانتقالية الداخلية
العناصر الداخلية الانتقالية لها العديد من التطبيقات العلمية والعسكرية والصناعية، والتي منها ما يلي:
- العناصر الانتقالية الداخلية تدخل في صناعة الدروع الواقية من الإشعاعات.
- الأمريسيوم يدخل في تصنيع كاشفات الدخان، والتي تحتوي على كمية دقيقة منه وينتج عنها إشعاعات مؤينة.
- يتم استخدام هذه العناصر في توليد الطاقة في محطات الطاقة النووية، حيث إن بعض تصميمات المفاعلات النووية تستخدم الثوريوم.
- عنصري السماريوم واللوتيتيوم يدخلان في تصنيع المغناطيسات التي لها قوة جذب عالية.
- يتم استخدام اللانثانيدات في إنتاج أشعة الليزر.
- يتم استخدام تقنية يستخدم فيها اليورانيوم والثوريوم في تحديد أعمار الأحافير والصخور.
وإلى هنا نصل إلى نهاية مقالنا الذي عرضنا فيه كيفية حساب التوزيع الإلكتروني لعناصر الجدول الدوري، حيث إن الخواص الكيميائية للذرية تعتمد بشدة على ترتيب الإلكترونات في غلافها الخارجي، وهو يساهم في كيمياء العناصر.
Questions & Answers
مستويات الطاقة السبعة هي (K, L, M, N, O, P, Q).
التوزيع الإلكتروني للكلور هو (Ne) 3s² 3p⁵.
عدد مستويات الطاقة الفرعية هي أربعة مستويات.

تعليقات