الجدول الدوري للعناصر.. كم مجموعة في الجدول الدوري للعناصر؟

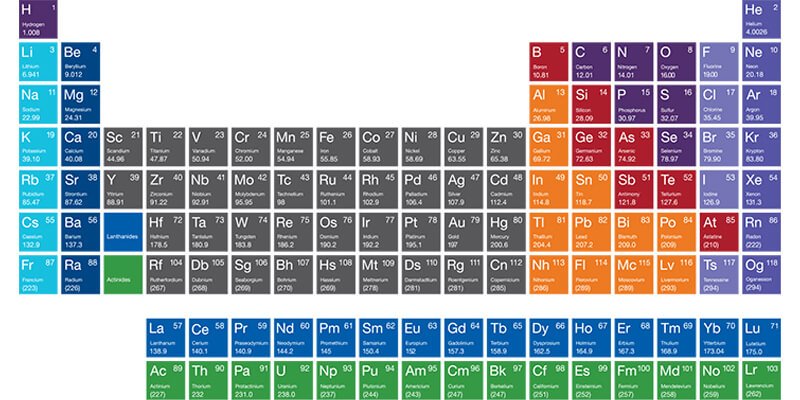
الجدول الدوري للعناصر هو أداة أساسية في علم الكيمياء، حيث ينظم العناصر الكيميائية وفقاً لخصائصها وخصائصها الإلكترونية، تم تطوير هذا الجدول لأول مرة في عام 1869 على يد العالم الروسي ديمتري مندليف، ومنذ ذلك الحين أصبح أداة لا غنى عنها في البحث العلمي والتعليم، يتم ترتيب العناصر في الجدول الدوري بناءً على ترتيبها الذري.
الجدول الدوري للعناصر
الجدول الدوري للعناصر هو أداة تُستخدم في الكيمياء لتنظيم العناصر بناءً على خصائصها، يتضمن الجدول الدوري ما هو آتي:
- المجموعات: وهي الأعمدة التي تحتوي على عناصر تشترك في خصائص كيميائية مشابهة، مثل مجموعة الفلزات القلوية أو مجموعة الهالوجينات.
- الفترات: وهي الصفوف الأفقية التي تُظهر التغيرات التدريجية في الخصائص الكيميائية والفيزيائية للعناصر.
- الكتل: تشمل الكتل المختلفة مثل الكتلة s، p، d، و f، والتي تمثل تدرجات في الخصائص الإلكترونية للعناصر.
- الألوان: تُستخدم لتصنيف العناصر حسب أنواعها مثل الفلزات واللافلزات وأشباه الفلزات.
يعد الجدول أداة مهمة للتنبؤ بخصائص العناصر والتفاعلات الكيميائية، ويساعد في فهم العلاقة بين العناصر والمواد الكيميائية بشكل عام.
كم مجموعة في الجدول الدوري للعناصر
الجدول الدوري للعناصر يحتوي على عدة مجموعات رئيسية، كل منها تتسم بخصائص كيميائية و فيزيائية مميزة، إليك أبرز هذه المجموعات:
- المجموعة الأولى (الفلزات القلوية): تشمل العناصر مثل الليثيوم (Li) والصوديوم (Na) والبوتاسيوم (K)، وتتميز بكونها شديدة التفاعل مع الماء وتكوين قواعد قوية.
- المجموعة الثانية (الفلزات القلوية الترابية): تشمل العناصر مثل البيريليوم (Be) والمغنيسيوم (Mg) والكالسيوم (Ca)، تتفاعل أقل من الفلزات القلوية ولكنها ما زالت تفاعلها ملحوظاً.
- المجموعة الثالثة إلى المجموعة الثانية عشرة (الفلزات الانتقالية): تشمل عناصر مثل الحديد (Fe) والنحاس (Cu) والذهب (Au)، تُعرف بخصائصها المتنوعة وتستخدم في العديد من التطبيقات الصناعية.
- المجموعة الثالثة عشرة (الفلزات الأساسية ): تشمل العناصر مثل البورون (B) والألومنيوم (Al) والجرمانيوم (Ge)، هذه العناصر تتسم بخصائص كيميائية تتوسط بين الفلزات واللافلزات.
- المجموعة الرابعة عشرة (الكربونات): تشمل العناصر مثل الكربون (C) والسيليكون (Si) والقصدير (Sn)، تُعرف بقدرتها على تكوين مركبات متنوعة.
- المجموعة الخامسة عشرة(النيتروجينية): تشمل العناصر مثل النيتروجين (N) والفسفور (P) والزرنيخ (As)، تُعرف بقدرتها على تشكيل روابط متعددة.
- المجموعة السادسة عشرة(الأكسجينيات): تشمل العناصر مثل الأكسجين (O) والكبريت (S) والسيلينيوم (Se). تتسم بقدرتها على التفاعل مع الفلزات لتكوين أكاسيد.
- المجموعة السابعة عشرة (الهالوجينات): تشمل العناصر مثل الفلور (F) والكلور (Cl) واليود (I)، تُعرف بتفاعلها الشديد مع الفلزات لتكوين الأملاح.
- المجموعة الثامنة عشرة (الغازات النبيلة): تشمل العناصر مثل الهيليوم (He) والنيون (Ne) والأرجون (Ar)، تتميز بأنها غير تفاعلية إلى حد كبير بفضل غلافها الإلكتروني الكامل.
تاريخ الجدول الدوري
تطور الجدول الدوري للعناصر على مر الزمن بفضل إسهامات عدة علماء:
- ديمتري مندليف (1869): طور ديمتري مندليف أول جدول دوري معروف، حيث رتب العناصر حسب أوزانها الذرية وخصائصها الكيميائية.
- لوني لوثر مير (1869): بينما كان مندليف يطور جدوله، قدم لوثر مير جدولاً مماثلاً يتضمن ترتيب العناصر وفقاً لأوزانها الذرية، لكنه لم يكن شائعاً كما هو الحال مع جدول مندليف.
- هنري موزلي (1913): استخدم هنري موزلي الأشعة السينية لتحديد الأعداد الذرية للعناصر، مما أدى إلى تصحيح الجدول الدوري من حيث الترتيب بناءً على الأعداد الذرية بدلاً من الأوزان الذرية.
- الجدول الدوري الحديث: بعد اكتشاف الأعداد الذرية، أصبح الجدول الدوري يرتب العناصر بناءً على ترتيبها الذري، تطور الجدول ليشمل عناصر جديدة تم اكتشافها، وتم إدراج العناصر في فئات وكتل محددة وفقاً لخصائصها الكيميائية والفيزيائية.
تصنيف العناصر في الجدول الدوري
في الجدول الدوري، يتم تصنيف العناصر إلى فئات رئيسية بناءً على خصائصها الكيميائية والفيزيائية، تشمل هذه الفئات:
- الغازات النبيلة: تقع في المجموعة الثامنة عشرة من الجدول الدوري، وتشمل الهيليوم (He)، النيون (Ne)، الأرجون (Ar)، الكريبتون (Kr)، الزينون (Xe)، والرادون (Rn)، تمتاز بكونها غير تفاعلية بفضل امتلاء غلافها الإلكتروني.
- العناصر المثالية: يُشير مصطلح “العناصر المثالية” عادةً إلى العناصر التي تُظهر خصائص مستقرة ومثالية في شروط معينة، ولكن لا تُعتبر فئة رسمية في الجدول الدوري.
- العناصر الانتقالية الرئيسية: تقع في المجموعات من الثالثة إلى الثانية عشرة.
- العناصر الداخلية: وهي اللانثانيدات والأكتينيدات.
كل مجموعة من هذه العناصر تتميز بخصائص خاصة تؤثر على استخداماتها وتفاعلاتها في الكيمياء والعلوم الأخرى.
في نهاية المقال قدمنا لكم الجدول الدوري للعناصر، وعرضنا بعدها كم مجموعة في الجدول الدوري للعناصر، وذكرنا بعد ذلك تاريخ الجدول الدوري، وختمنا المقال بذكر تصنيف العناصر في الجدول الدوري.
اقرأ أيضَا
Questions & Answers
عدد عناصر الجدول الدوري هم 118 عنصر.
عنصر 104 هو الرذرفورديوم.
أقوى عنصرة هو هيدروكسيد السيزيوم.

تعليقات